Δημοσιεύθηκε στις 9 Φεβρουαρίου ο Εκτελεστικός Κανονισμός (ΕΕ) 2022/168 για την έγκριση της διάθεσης στην Ενωσιακή αγορά του παστεριωμένου Akkermansia muciniphila ως νέου τροφίμου.
Η διαδικασία ξεκίνησε στις 24 Οκτωβρίου 2019, όταν η εταιρεία A-Mansia Biotech SA υπέβαλε αίτηση στην Επιτροπή για τη διάθεση στην αγορά της Ένωσης του παστεριωμένου Akkermansia muciniphila ως νέου τροφίμου. Η αιτούσα ζήτησε να χρησιμοποιείται ως νέο τρόφιμο σε συμπληρώματα διατροφής και σε τρόφιμα που προορίζονται για ειδικούς ιατρικούς σκοπούς, τα οποία προορίζονται για τον ενήλικο πληθυσμό, με εξαίρεση τις εγκύους και τις θηλάζουσες γυναίκες.
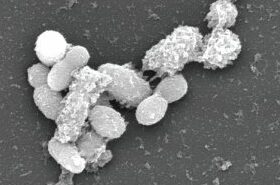
Το παστεριωμένο Akkermansia muciniphila (στέλεχος ATCC BAA-835, CIP 107961) παράγεται με αναερόβια καλλιέργεια του βακτηρίου, ακολουθούμενη από παστερίωση, συμπύκνωση των κυττάρων, κρυοσυντήρηση και λυοφιλίωση.
Σύμφωνα με τον νέο Κανονισμό, για περίοδο 5 ετών μόνο η εταιρεία A-Mansia Biotech SA με έδρα στο Βέλγιο, λαμβάνει έγκριση να διαθέτει στην αγορά της Ένωσης το νέο τρόφιμο, εκτός εάν επόμενος αιτών λάβει έγκριση για το ίδιο νέο τρόφιμο χωρίς αναφορά στα στοιχεία που προστατεύονται, ή με τη σύμφωνη γνώμη της αρχικής αιτούσας εταιρείας.
Η καταχώριση στον ενωσιακό κατάλογο των νέων τροφίμων περιλαμβάνει τις προϋποθέσεις χρήσης και τις απαιτήσεις επισήμανσης που καθορίζονται στο παράρτημά του.
Η ονομασία του νέου τροφίμου στην επισήμανση των τροφίμων στα οποία περιέχεται είναι “παστεριωμένο Akkermansia muciniphila”.
Η επισήμανση των συμπληρωμάτων διατροφής που περιέχουν παστεριωμένο Akkermansia muciniphila φέρει δήλωση που αναφέρει ότι πρέπει να καταναλώνονται μόνο από ενήλικες, με εξαίρεση τις εγκύους και τις θηλάζουσες γυναίκες.
Για να διαβάσετε ολόκληρο το νέο κανονισμό και να δείτε τις απαιτήσεις και προδιαγραφές που ορίζονται στο παράρτημα, πατήστε εδώ

 Ακολουθήστε το Cibum
Ακολουθήστε το Cibum 













